Solución Problema 1 de la Ley de Boyle - Mariotte
Vamos a resolver el ejercicio propuesto para reforzar los conocimientos adquiridos en el tema de La Ley de Boyle - Mariotte en el área de la teoría cinética de los gases, con este ejemplo resuelto el alumno podrá corroborar su respuesta y verificar si ha llegado al mismo resultado. ??
Nivel de Dificultad: ⭐⭐
Solución:
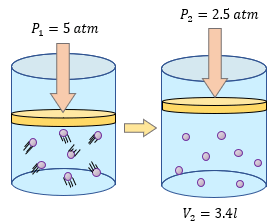
En los problemas de Boyle - Mariotte, es importante verificar primeramente las variables con las que se identifica dicha ley, tal como la presión y el volumen. En este claro ejemplo tenemos tanto a la presión inicial, así como la presión final, y el volumen final, y lógicamente el que nos faltaría sería el volumen inicial.
- Obtener el volumen inicial
Datos:
$ \displaystyle {{P}_{1}}=5atm$
$ \displaystyle {{P}_{2}}=2.5atm$
$ \displaystyle {{V}_{2}}=3.4l$
a) Obtener el volumen inicial
Escribimos la fórmula de la ley de Boyle Mariotte:
$ \displaystyle {{P}_{1}}{{V}_{1}}={{P}_{2}}{{V}_{2}}$
Como la incógnita, o variable a encontrar es el volumen inicial, entonces despejamos a V1
$ \displaystyle {{V}_{1}}=\frac{{{P}_{2}}{{V}_{2}}}{{{P}_{1}}}$
Ahora sustituimos nuestros datos en la fórmula:
$ \displaystyle {{V}_{1}}=\frac{{{P}_{2}}{{V}_{2}}}{{{P}_{1}}}=\frac{\left( 2.5atm \right)\left( 3.4l \right)}{5atm}=1.7l$
Es decir que nuestro volumen inicial es de 1.7 litros
Respuesta:
$ \displaystyle {{V}_{1}}=1.7l$
