Solución Problema 2 de la Ley de Boyle - Mariotte
En este segundo ejercicio resuelto, nuevamente vamos a reforzar los conocimientos adquiridos en el tema de La Ley de Boyle - Mariotte en el área de la teoría cinética de los gases, con este ejemplo resuelto, el alumno podrá corroborar su respuesta y verificar si ha llegado al mismo resultado. ??
Nivel de Dificultad: ⭐⭐
Solución:
Si leemos bien el problema la forma de solución es muy sencilla, porque nos proporciona las condiciones iniciales, tales como el volumen inicial, y las dos presiones (inicial y final). Lo que el problema nos pide es encontrar el volumen final, que será muy sencillo de calcular.
- Obtener el volumen final del gas
Datos:
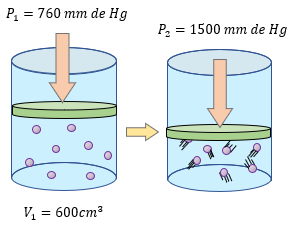
$ \displaystyle {{P}_{1}}=760mmdeHg$
$ \displaystyle {{P}_{2}}=1500mmdeHg$
$ \displaystyle {{V}_{1}}=600c{{m}^{3}}$
a) Obtener el volumen final del gas
Recordemos que nuestra ley de Boyle - Mariotte tiene por fórmula la siguiente igualdad:
$ \displaystyle {{P}_{1}}{{V}_{1}}={{P}_{2}}{{V}_{2}}$
Como la incógnita es el volumen final, es decir V2, entonces despejamos:
$ \displaystyle {{V}_{2}}=\frac{{{P}_{1}}{{V}_{1}}}{{{P}_{2}}}$
Ahora sustituimos nuestros datos en la fórmula:
$ \displaystyle {{V}_{2}}=\frac{{{P}_{1}}{{V}_{1}}}{{{P}_{2}}}=\frac{\left( 760mmdeHg \right)\left( 600c{{m}^{3}} \right)}{1500mmdeHg}=304c{{m}^{3}}$
Por lo que el volumen final del gas es de 304cm³
Resultado:
$ \displaystyle {{V}_{2}}=304c{{m}^{3}}$
