Leyes de la Termodinámica - Ejercicios Resueltos

Hoy hablaremos sobre las leyes de la termodinámica, estas leyes tienen algo especial y es que forman parte de un concepto muy controversial en física.
Alguna vez te has preguntado, ¿Por qué el tiempo fluye en una sola dirección?, o quizá interrogarte ¿Por qué envejecemos y no volvemos a ser jóvenes otra vez?, o si es posible el cambiar la fluidez del tiempo en dirección contraria a como avanza, muchas de estas preguntas tienen una respuesta concisa, pero la gran problemática surge en la segunda ley de la termodinámica, porque rigurosamente nos da a entender que el flujo del tiempo solo debe apuntar en una sola dirección.
La termodinámica como wikipedia nos explica o bien sacando un resumen de lo explicado, podríamos decir que:
La termodinámica se puede sintetizar en cuatro leyes, sin embargo en este artículo solamente hablaremos de la primera Ley de la Termodinámica, así como ejercicios resueltos y de práctica para entender mucho mejor el tema.
¿Qué es la primera ley de la termodinámica?
La Primera Ley de la Termodinámica la podrás reconocer fácilmente con aquella frase muy famosa que dice "La energía no se crea ni se destruye, solo se transforma", pues ciertamente la primera ley hace referencia que el calor suministrado a un sistema es igual a la suma del incremento en la energía interna de éste y el trabajo realizado por el sistema sobre sus alrededores.
Esta ley también la podemos encontrar en algunos textos de Física como aquella ley que establece el Principio de Conservación de la Energía.
La primera ley de la termodinámica la definiremos en conceptos matemáticos para hacerla más entendible.
$\displaystyle \Delta Q=\Delta U+\Delta W$
Dónde;
$\displaystyle \Delta Q$ = Calor suministrado al sistema [Cal, Joules]
$\displaystyle \Delta U$ = Incremento en la energía del sistema [ Cal, Joules]
$ \displaystyle \Delta W$= Trabajo realizado por el sistema [Cal, Joules]
Reglas importantes para la solución de ejercicios y problemas
El signo de $\displaystyle \Delta Q$ es positivo cuando al sistema se le suministra calor y es negativo si el sistema cede calor.
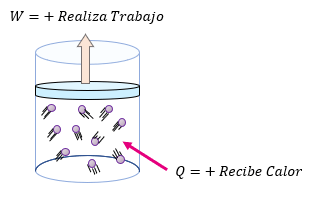
El signo de $\displaystyle \Delta W$ es positivo cuando el sistema realiza trabajo y negativo cuando el trabajo se realiza sobre él.
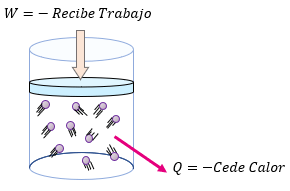
Si el sistema incrementa su temperatura el signo $\displaystyle \Delta U$ es positivo, y si disminuye su temperatura es negativo.
⭐ Fórmula de la Primera Ley de la Termodinámica
En forma de resumen hasta este momento, podemos entonces colocar la fórmula de la primera ley, que es la siguiente:
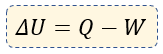
Veamos los siguientes ejemplos, para entender finalmente a emplear dicha fórmula ?
Ejercicios Resueltos de la Primera Ley de la Termodinámica
Solución:
El problema indica que se le están suministrando 700 calorías de calor, eso quiere decir que $\displaystyle \Delta Q$ será positivo, por otra parte nos dice que al sistema se le aplicará un trabajo de 900 Joules, aquí el signo de $\displaystyle \Delta W$ tendrá que ser negativo, puesto que se la están aplicando al sistema.
Sabiendo ese análisis podemos dar solución al problema de la siguiente forma:
Vamos a convertir las 700 calorías de calor en Joules. ¿Por qué? Porque el S.I (Sistema Internacional) de medida así lo estandariza.
$\displaystyle 700cal\left[ \frac{4.2J}{1cal} \right]=2940J$
Recordar que $\displaystyle \Delta W=-900J$ porque como dijimos, al sistema se le está aplicando un trabajo. Ahora conforme a la fórmula de la primera ley de la termodinámica, iniciemos a sustituir.
$\displaystyle \Delta Q=\Delta U+\Delta W$
despejando " $\displaystyle \Delta U$"
$\displaystyle \Delta U=\Delta Q-\Delta W$
Sustituyendo
$\displaystyle \Delta U=2940J-(-900J)=2940+900=3840J$
Ese sería el resultado de nuestro incremento en la energía interna.
Veamos otro ejemplo, para entender a grandes rasgos la primer ley de la termodinámica 😀
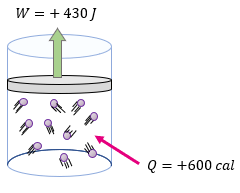
a) El sistema absorbe 100 cal y realiza un trabajo de 200 J.
b) El sistema absorbe 100 cal y sobre él se realiza un trabajo de 200 J.
c) El sistema libera 100 cal de calor a la vencidad (alrededor), y sobre él se realiza un trabajo de 200 J.
Solución:
a) Para iniciar a resolver este inciso, debemos entender lo que nos pide.
+ El sistema absorbe 100 cal , que convertiremos en Joules.
+ El sistema realiza el trabajo de 200 J.
Convertimos lo que que absorbe el sistema:
$\displaystyle 100cal\left( \frac{4.18J}{1cal} \right)=418J$
Ahora esto nos indica que por fórmula tendremos:
$ \displaystyle \Delta U=\Delta Q-\Delta T$
$\displaystyle \Delta U=418J-200J=218J$
Observamos que la energía interna del sistema aumenta considerablemente a 218 J.
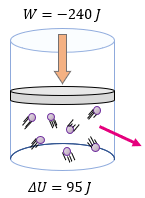
b) Para este caso analizamos de la siguiente manera el inciso.
+ El sistema absorbe 100 cal
- El trabajo fue realizado sobre el sistema 200J
Por fórmula tenemos:
$\displaystyle \Delta U=418J-(-200J)=618J$
Por lo que ahora, tenemos 618 Joules, y observamos un gran incremento de la energía interna.
Y finalmente el último inciso.
c) En este caso el sistema hace las dos versiones distintas al inciso a), pues aquí tenemos el siguiente análisis.
- El sistema libera 100 cal [Se convierte a Joules]
- Se le aplica un trabajo sobre el sistema de 200 J
Por fórmula tendríamos algo así:
$\displaystyle \Delta U=-418J-(-200J)=-418J+200J=-218J$
Vemos que la energía del sistema disminuye considerablemente, y esto es lógico puesto que nada más recibió 200 J de energía y a su vez estaba liberando 418 Joules.
Segunda ley: Por si mismo el calor no aumenta, puede disminuir pero no aumenta, siempre que aumenta tiene que ser por alguna forma de energía, esta ley es una de las más interesantes por lo que haremos un tema especial para ella, dándole click aquí te llevará al artículo dedicado 😀
Tercera ley: Esta ley da a explicar que una temperatura absoluta de cero grado es imposible alcanzar, la temperatura es una medida de la velocidad promedio de las moléculas de una sustancia. Podemos ensayar por todos los medios pero no podemos lograr que el movimiento molecular cese por completo.
Ley cero: Esto sin duda la podríamos explicar sin mucho texto, y es que la ley cero explica que si dos objetos están en equilibrio térmico es decir que tienen la misma temperatura, con un tercero que llamaremos termómetro, están equilibrio térmico entre sí. Esto parece tan obvio de cierta forma que parece que no debería considerarse una ley.
Lo curioso
Lo curioso de estas leyes es su descubrimiento y como fueron tomadas en cuenta, La segunda ley fue descubierta primero. Luego vino la primera ley. La tercera fue realmente la tercera, pero tal vez no es una ley aparte (porque puede considerarse una extensión de la segunda ley). La ley cero fue la última, como una idea tardía entre los científicos.
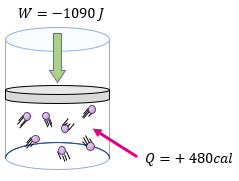
Ejercicios para practicar de la primera ley de la termodinámica
A continuación se muestran algunos ejercicios para practicar la primera ley de la termodinámica, en estos ejercicios también el alumno puede corroborar sus resultados, ya que contienen la solución paso a paso. ??
¿Te gustó este contenido?
Únete a nuestra comunidad en WhatsApp o Telegram para recibir nuevos proyectos, tutoriales y noticias exclusivas.
-
Los contenidos son claros de una buena calidad en su contenido
★★★★★
-
Todos los ejercicios resueltos
★★★★★
54 Deja tu comentario
Deja una respuesta

Estos temas te pueden interesar