Ley general del estado gaseoso - Ejercicios Resueltos

Cómo están amig@s?? Hoy traigo un post que es de gran importancia para entender el comportamiento de los gases y que también cierra la saga de temas individuales por cada variable, es decir: temperatura, presión y volumen.
Entonces, vamos a comenzar. Nuevamente te pido que tomes asiento, papel, lápiz, calculadora, borrador y demás para poder comprender este tema.
Otra cosa, antes de poder iniciar, es necesario que sepas por lo menos de que va, la ley de Charles, la ley de Gay-Lussac y la ley de Boyle-Mariotte, ¿No tienes idea?, entonces te sugiero que los leas 🙂
? Ecuación general del estado gaseoso
La ecuación general del estado gaseoso es una combinación de las ecuaciones antes mencionadas, donde nuevamente las variables a encontrar son la presión, temperatura o volumen del gas, cuando se tiene un cambio entre dos variables.
La expresión matemática, o fórmula de la ecuación general del estado gaseoso, es la siguiente:
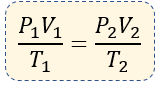
$ \displaystyle \frac{{{P}_{1}}{{V}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}{{V}_{2}}}{{{T}_{2}}}$
Dónde:
$ \displaystyle {{P}_{1}}$ = Presión Inicial
$ \displaystyle {{V}_{1}}$ = Volumen Inicial
$ \displaystyle {{T}_{1}}$ = Temperatura Inicial
$ \displaystyle {{P}_{2}}$ = Presión Final
$ \displaystyle {{V}_{2}}$ = Volumen Final
$ \displaystyle {{T}_{2}}$ = Temperatura Final
¡Recordar!, las temperaturas se manejan en escalas absolutas, es decir en °K
Pero como siempre, es mejor aprender las cosas mediante ejercicios resueltos, y aquí te presento algunos.
? Ejercicios resueltos de la ley general del estado gaseoso
Solución:
Puede sonar confuso si no entendemos el problema, pero no es difícil si vamos considerando los datos que el mismo problema nos arroja. Cómo podrás darte cuenta hay un volumen inicial de la toma del oxígeno, así cómo una presión y temperatura y al final, nos preguntan sobre el volumen, es decir nuestra incógnita y a la vez dándonos dos datos más, la temperatura y presión final, por lo que ahora tomaremos esos datos:
$ \displaystyle {{P}_{1}}$ = 480 mm de Hg
$ \displaystyle {{V}_{1}}$ = 450 ml
$ \displaystyle {{T}_{1}}$ = 30° + 273 = 303 K
$ \displaystyle {{P}_{2}}$ = 650 mm de Hg
$ \displaystyle {{T}_{2}}$ = 45°C + 273 = 318 K
$ \displaystyle {{V}_{2}}$ = ???
Según nuestra fórmula:
$ \displaystyle \frac{{{P}_{1}}{{V}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}{{V}_{2}}}{{{T}_{2}}}$
Despejaríamos la variable $ \displaystyle {{V}_{2}}$ de la ecuación.
$ \displaystyle {{V}_{2}}=\frac{{{P}_{1}}{{V}_{1}}{{T}_{2}}}{{{P}_{2}}{{T}_{1}}}$
Por lo que si sustituimos, tendremos que:
$ \displaystyle {{V}_{2}}=\frac{(480mmHg)(450ml)(318K)}{(650mmHg)(303K)}=348.75ml$
Veamos otro ejercicio.
Solución:
Para este caso, haremos lo mismo que en el primer ejercicio, y es que es mejor empezar a analizar nuestros datos para así poder entrarle al problema, así que iniciemos.
$ \displaystyle {{P}_{1}}$ = 1 atm
$ \displaystyle {{V}_{1}}$ = 300 ml
$ \displaystyle {{T}_{1}}$ = 35° + 273 = 308 K
$ \displaystyle {{P}_{2}}$ = 1.5 atm
$ \displaystyle {{V}_{2}}$ = 100 ml
$ \displaystyle {{T}_{2}}$ = ?
Ahora proseguimos a usar nuestra formula de la ley general del estado gaseoso
$ \displaystyle \frac{{{P}_{1}}{{V}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}{{V}_{2}}}{{{T}_{2}}}$
Despejando la variable $ \displaystyle {{T}_{2}}$
$ \displaystyle {{T}_{2}}=\frac{{{P}_{2}}{{V}_{2}}{{T}_{1}}}{{{P}_{1}}{{V}_{1}}}$
Sustituimos nuestros datos
$ \displaystyle {{T}_{2}}=\frac{(1.5atm)(100ml)(308K)}{(1atm)(300ml)}=154K$
Pero OJO! aquí no ha terminado el problema, ya que nos pide el valor de la temperatura final pero expresada en grados celcius -> °C
$ \displaystyle {{T}_{2}}=154K-273$
$ \displaystyle {{T}_{2}}=-119{}^\circ C$
Por lo que la temperatura final, disminuye drásticamente a una cantidad mínima, lo que sería una escala muy pero muy baja.
....Fin....
¿Dudas?
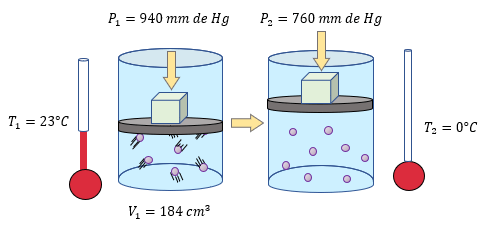
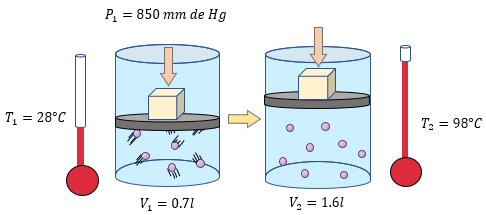
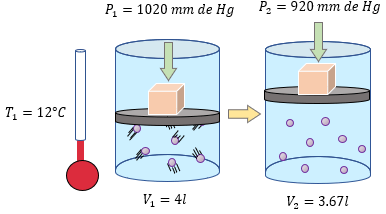
? Ejercicios para Practicar la Ley General del Estado Gaseoso
A continuación se muestran algunos ejemplos resueltos paso a paso, donde podrá corroborar sus resultados con la solución: ??
¿Te gustó este contenido?
Únete a nuestra comunidad en WhatsApp o Telegram para recibir nuevos proyectos, tutoriales y noticias exclusivas.
-
Que te asen aprender cuale son lo conponentes químicos
-
Tengo una duda referente al segundo problema resulto, ¿Por que la temperatura final disminuye hasta -119 °C, me refiero a que es una disminución muy drástica, esto se debe a una característica del gas o algo así?
-
Me pueden ayudar con este problema: Calcula el volumen que ocupan 14.89g de cloro (CI) cuando es transportado a una presión de 750mm de Hg y una temperatura de 30°C. Supongo que se comparta de manera ideal
-
cual es la formula del estado gaseoso
-
El volumen de un globo es de 4 litros a una temperatura de 27 °C y una atmósfera de presión. ¿ Cuál es el volumen si la temperatura se incrementa en 30 °C con respecto al inicial? *
2,26 L
4,76 L
6,66 L
8,86 L
Una muestra de gas ocupa un volumen de 0,6 litros a una presión de 1140 mmHg y una temperatura de 18°C. Si se disminuye la presión a 760 mmHg. ¿Cuál es el volumen de gas? *0,091 mL
0,954 L
900,0 mL
0,684 L
¿Cuáles son los valores de la Presión, Temperatura y volumen en Condiciones normales o estándar? *
1 atm; 25ºC y 22,414 L
760 mmHg; 273ºK y 22,414 L
2 atm; 0ºC y 1000 mL
Una de las siguientes fórmulas no corresponde a ninguna ley de los gases estudiada *
2 puntos
V1 P1= V2 P2
PV = nrT
V1T2 =V2T1
P1T2 =P2 T1
El volumen de un gas a 30°C y a una atmósfera de presión es 160 L. ¿Qué volumen ocupará este gas a 70 °C y 800 mmHg de presión? *
171,50 L
172,16 L
173,61L
174,49 L
32 Deja tu comentario
Deja una respuesta

Estos temas te pueden interesar