Ley general del estado gaseoso - Ejercicios Resueltos

Cómo están amig@s?? Hoy traigo un post que es de gran importancia para entender el comportamiento de los gases y que también cierra la saga de temas individuales por cada variable, es decir: temperatura, presión y volumen.
Entonces, vamos a comenzar. Nuevamente te pido que tomes asiento, papel, lápiz, calculadora, borrador y demás para poder comprender este tema.
Otra cosa, antes de poder iniciar, es necesario que sepas por lo menos de que va, la ley de Charles, la ley de Gay-Lussac y la ley de Boyle-Mariotte, ¿No tienes idea?, entonces te sugiero que los leas 🙂
? Ecuación general del estado gaseoso
La ecuación general del estado gaseoso es una combinación de las ecuaciones antes mencionadas, donde nuevamente las variables a encontrar son la presión, temperatura o volumen del gas, cuando se tiene un cambio entre dos variables.
La expresión matemática, o fórmula de la ecuación general del estado gaseoso, es la siguiente:
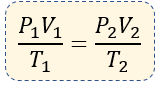
$ \displaystyle \frac{{{P}_{1}}{{V}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}{{V}_{2}}}{{{T}_{2}}}$
Dónde:
$ \displaystyle {{P}_{1}}$ = Presión Inicial
$ \displaystyle {{V}_{1}}$ = Volumen Inicial
$ \displaystyle {{T}_{1}}$ = Temperatura Inicial
$ \displaystyle {{P}_{2}}$ = Presión Final
$ \displaystyle {{V}_{2}}$ = Volumen Final
$ \displaystyle {{T}_{2}}$ = Temperatura Final
¡Recordar!, las temperaturas se manejan en escalas absolutas, es decir en °K
Pero como siempre, es mejor aprender las cosas mediante ejercicios resueltos, y aquí te presento algunos.
[alert-warning]Cuando resuelva problemas, y lea el enunciado decir que un gas está a condiciones normales, quiere decir que el gas se considera a 0°C es decir a 273K, y a una presión de una atmósfera igual a 760 mm de Hg.[/alert-warning]
? Ejercicios resueltos de la ley general del estado gaseoso
Solución:
Puede sonar confuso si no entendemos el problema, pero no es difícil si vamos considerando los datos que el mismo problema nos arroja. Cómo podrás darte cuenta hay un volumen inicial de la toma del oxígeno, así cómo una presión y temperatura y al final, nos preguntan sobre el volumen, es decir nuestra incógnita y a la vez dándonos dos datos más, la temperatura y presión final, por lo que ahora tomaremos esos datos:
$ \displaystyle {{P}_{1}}$ = 480 mm de Hg
$ \displaystyle {{V}_{1}}$ = 450 ml
$ \displaystyle {{T}_{1}}$ = 30° + 273 = 303 K
$ \displaystyle {{P}_{2}}$ = 650 mm de Hg
$ \displaystyle {{T}_{2}}$ = 45°C + 273 = 318 K
$ \displaystyle {{V}_{2}}$ = ???
Según nuestra fórmula:
$ \displaystyle \frac{{{P}_{1}}{{V}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}{{V}_{2}}}{{{T}_{2}}}$
Despejaríamos la variable $ \displaystyle {{V}_{2}}$ de la ecuación.
$ \displaystyle {{V}_{2}}=\frac{{{P}_{1}}{{V}_{1}}{{T}_{2}}}{{{P}_{2}}{{T}_{1}}}$
Por lo que si sustituimos, tendremos que:
$ \displaystyle {{V}_{2}}=\frac{(480mmHg)(450ml)(318K)}{(650mmHg)(303K)}=348.75ml$
Veamos otro ejercicio.
Solución:
Para este caso, haremos lo mismo que en el primer ejercicio, y es que es mejor empezar a analizar nuestros datos para así poder entrarle al problema, así que iniciemos.
$ \displaystyle {{P}_{1}}$ = 1 atm
$ \displaystyle {{V}_{1}}$ = 300 ml
$ \displaystyle {{T}_{1}}$ = 35° + 273 = 308 K
$ \displaystyle {{P}_{2}}$ = 1.5 atm
$ \displaystyle {{V}_{2}}$ = 100 ml
$ \displaystyle {{T}_{2}}$ = ?
Ahora proseguimos a usar nuestra formula de la ley general del estado gaseoso
$ \displaystyle \frac{{{P}_{1}}{{V}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}{{V}_{2}}}{{{T}_{2}}}$
Despejando la variable $ \displaystyle {{T}_{2}}$
$ \displaystyle {{T}_{2}}=\frac{{{P}_{2}}{{V}_{2}}{{T}_{1}}}{{{P}_{1}}{{V}_{1}}}$
Sustituimos nuestros datos
$ \displaystyle {{T}_{2}}=\frac{(1.5atm)(100ml)(308K)}{(1atm)(300ml)}=154K$
Pero OJO! aquí no ha terminado el problema, ya que nos pide el valor de la temperatura final pero expresada en grados celcius -> °C
$ \displaystyle {{T}_{2}}=154K-273$
$ \displaystyle {{T}_{2}}=-119{}^\circ C$
Por lo que la temperatura final, disminuye drásticamente a una cantidad mínima, lo que sería una escala muy pero muy baja.
....Fin....
¿Dudas?
? Ejercicios para Practicar la Ley General del Estado Gaseoso
A continuación se muestran algunos ejemplos resueltos paso a paso, donde podrá corroborar sus resultados con la solución: ??
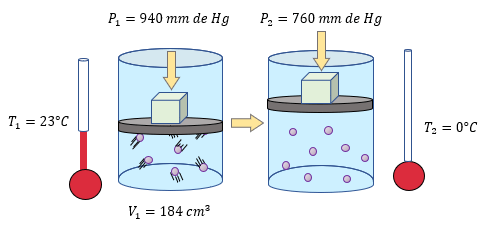
[alert-note]Problema 3.- Calcular el volumen que ocupará un gas en condiciones normales, si a una presión de 940 mm de Hg y 23°C su volumen es de 184 cm³ [/alert-note]
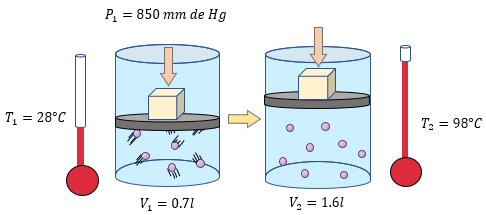
[alert-note]Problema 4.- Una masa de hidrógeno gaseoso ocupa un volumen de 0.7 litros a una temperatura de 28 °C y a una presión absoluta de 850 mm de Hg. ¿Cuál será su presión absoluta si su temperatura aumenta a 98°C y su volumen es de 1.6 litros? [/alert-note]
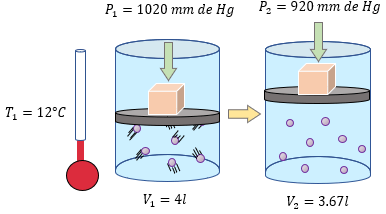
[alert-note]Problema 5.- A un gas que está dentro de un recipiente de 4 litros se le aplica una presión absoluta de 1020 mm de Hg, y su temperatura es de 12°C. ¿Cuál será su temperatura si ahora recibe una presión absoluta de 920 mm de Hg y su volumen es de 3.67 litros [/alert-note]
¿Te gustó este contenido?
Únete a nuestra comunidad en WhatsApp o Telegram para recibir nuevos proyectos, tutoriales y noticias exclusivas.
-
Sera 1044
ya que t2=(261k .4560mmHg) / 1140= 1044 K -
Buenas Noches, tengo que rendir quimica y no estaría entendiendo mucho. Uno de los 4 ejercicios me dice:
Cierta masa de un gas se encuentra a -12°C y una presión de 1140 mmHg. Si se mantiene constante el volumen y se cuadruplica la presión, ¿Qué temperatura soportará el gas en esta nueva condición?Me serviría muchísimo que me ayuden con un paso a paso porque sinceramente no entiendo absolutamente nada, gracias!!!
-
Aún ocupas ayuda?
-
Hola necesito ayuda con este ejercicio por favor .
¿Que volumen ocupará 4,5 mol de un gas en condiciones normales de temperatura y presión?
-
-
Hola necesito ayuda con este ejercicio por favor:
-un termometro de gas hidrogeno tiene un volumen de 100,0 cm3 cuando se sumerge en un baño de agua helada a 0ºC. cuando se lo sumerge en cloro liquido hirviente, el volumen del hidrogeno a la misma presion es 87,2 cm3. encontrar la temperatura de ebullicion en k y en ºC-
sale 23,805 ?¿?¿ alguien
-
-
Calcula el.numero de moles de un gas de L que ocupa un volumen de 4,1a 27 celcius y 1,5 atm
-
es el ejercicio de mi mensual :v
se usa esta formula : Presion x Volumen = R x Temperatura x n (moles)
R = 62,4 mmHg (miligramos de mercurio)
o
R = 0,082 atm (atmosferas)
-
32 Deja tu comentario
Deja una respuesta

Estos temas te pueden interesar